De vorm van een molecuul hangt af van het aantal elektronenparen in de buitenste schil rond een centraal atoom. Als je eenmaal weet hoeveel bindingsparen en niet-verbindingsparen er zijn, is de rest eenvoudig
Directe opmerking over bindingsparen!
Geef geen aandacht aan dubbele bindingen, die tellen als één bindingspaar!

i. CO2 heeft voor dit doel slechts twee bindingsparen (hoewel we weten dat het er in werkelijkheid 4 heeft, 2 paren tussen elke zuurstof en de waterstof)
De vormen die moleculen aannemen, hebben alles te maken met de Valence shell electron pair repulsion theory (VSEPR). Dat klinkt ingewikkeld, maar de algemene regel is dat alle paren elkaar afstoten, zodat alle elektronenparen zich in alle drie de dimensies zullen verspreiden om zo ver mogelijk weg te komen. De vormen die door deze uitwaaiering worden gevormd zijn zeer belangrijk en kunnen de chemie van het molecuul enorm beïnvloeden.
| Geen paren van e- |
Geen paren van bindende e- | Geen niet- bindingsparen van e- | Naam van vorm | Rangement in ruimte | Bondshoeken | Voorbeelden |
|---|---|---|---|---|---|---|
| 2 | 2 | 0 | Lineair | 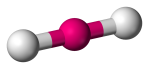 |
180o | CO2 |
| 3 | 3 | 0 | Trigonaal Planair | 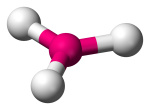 |
120o | BF3 |
| 3 | 2 | 1 | Angulier, V-vormig of gebogen |  |
120o | SO2 |
| 4 | 4 | 0 | Tetrahedraal | 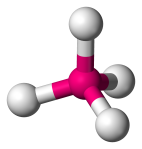 |
109.5o | CH4 |
| 4 | 3 | 1 | Trigonaal piramidaal | 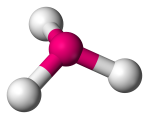 |
107o | NH3 |
| 4 | 2 | 2 | Angulier, V-vormig of gebogen |  |
104.5o | H2O |
| 6 | 0 | Octahedraal | 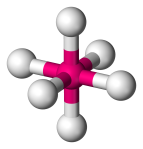 |
90o | SF6 |