La forma de una molécula depende del número de pares de electrones en la capa más externa que rodea al átomo central. Una vez que se sabe cuántos pares de enlace y pares de no enlace hay, el resto es fácil
¡Nota rápida sobre los pares de enlace!
¡Olvida los dobles enlaces, cuentan como un par de enlace!

por ejemplo. El CO2 para este propósito tiene sólo dos pares de enlace (aunque sabemos que en realidad tiene 4, 2 pares entre cada oxígeno y el hidrógeno)
Las formas que forman las moléculas tienen que ver con la teoría de repulsión de pares de electrones de la capa de valencia (VSEPR). Lo cual suena complicado, pero la regla general es que todos los pares se repelen entre sí, de modo que todos los pares de electrones se esparcen en las tres dimensiones para alejarse lo más posible. Las formas que se forman por esta dispersión son muy importantes y pueden influir mucho en la química de la molécula.
| Sin pares de e- |
Sin pares de enlace de e- | Sin pares de enlace no pares de enlace de e- | Nombre de la forma | Arreglo en el espacio | Ángulos de enlace | Ejemplos |
|---|---|---|---|---|---|---|
| 2 | 2 | 0 | Lineales | 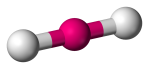 |
180o | CO2 |
| 3 | 3 | 0 | Trigonal Planar | 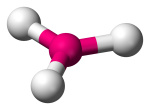 |
120o | BF3 |
| 3 | 2 | 1 | Angular, En forma de V o doblada |  |
120o | SO2 |
| 4 | 4 | 0 | Tetraédrica | 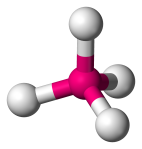 |
109.5o | CH4 |
| 4 | 3 | 1 | Pirámide Trigonal | 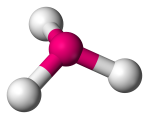 |
107o | NH3 |
| 4 | 2 | 2 | Angular, en forma de V o doblada |  |
104.5o | H2O |
| 6 | 6 | 0 | Octaédrica | 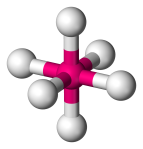 |
90o | SF6 |