La forma di una molecola dipende dal numero di coppie di elettroni nel guscio più esterno che circonda un atomo centrale. Una volta scoperto quante coppie di legame e quante coppie non di legame ci sono, il resto è facile
Nota veloce sulle coppie di legame!
Ignorate i doppi legami, contano come una coppia di legame!

Ecco. La CO2 per questo scopo ha solo due coppie di legami (anche se sappiamo che in realtà ne ha 4, 2 coppie tra ogni ossigeno e l’idrogeno)
Le forme che le molecole formano hanno a che fare con la teoria della repulsione delle coppie di elettroni del guscio di valenza (VSEPR). Il che sembra complicato, ma la regola generale è che tutte le coppie si respingono a vicenda, così che tutte le coppie di elettroni si diffondono nelle tre dimensioni in modo da allontanarsi il più possibile. Le forme che si formano con questa dispersione sono molto importanti e possono influenzare enormemente la chimica della molecola.
| Nessuna coppia di e- |
Nessuna coppia di e- | di legame di e- | Nome della forma | Disposizione nello spazio | Angoli di legame | Esempi |
|---|---|---|---|---|---|---|
| 2 | 2 | 0 | Lineare | 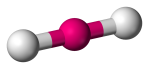 |
180o | CO2 |
| 3 | 3 | 0 | Piano trigonale | 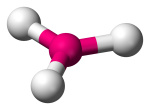 |
120o | BF3 |
| 3 | 2 | 1 | Angolare, V-shaped or Bent | 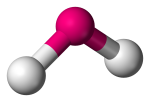 |
120o | SO2 |
| 4 | 4 | 0 | Tetraedrico | 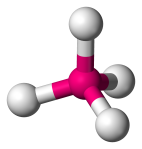 |
109.5o | CH4 |
| 4 | 3 | 1 | Piramidale trigonale | 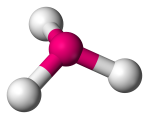 |
107o | NH3 |
| 4 | 2 | 2 | Angolare, a forma di V o piegato |  |
104.5o | H2O |
| 6 | 6 | 0 | Octaedrico | 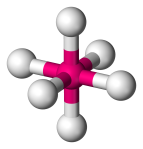 |
90o | SF6 |