Palladia Indicații
Comprimatele Palladia sunt indicate pentru tratamentul tumorilor mastocitare cutanate recidivante de gradul II sau III, de tip Patnaik, cu sau fără afectare ganglionară regională la câini.
Dosare și administrare
Ajutați întotdeauna fișa de informații pentru client cu prescripția medicală. Administrați o doză inițială de 3,25 mg/kg (1,48 mg/lb) greutate corporală, pe cale orală o dată la două zile (vezi tabelul 1). Reduceri ale dozei de 0,5 mg/kg (până la o doză minimă de 2,2 mg/kg (1,0 mg/lb) o dată la două zile) și întreruperi ale dozei (încetarea administrării PALLADIA timp de până la două săptămâni) pot fi utilizate, dacă este necesar, pentru a gestiona reacțiile adverse (vezi Tabelul 2, precum și Atenționări și precauții). Ajustați doza pe baza evaluărilor veterinare aproximativ săptămânale pentru primele 6 săptămâni și aproximativ la fiecare 6 săptămâni, ulterior. PALLADIA poate fi administrat cu sau fără alimente. Nu divizați comprimatele.
Tabelul 1. 3.Diagrama dozelor de 25 mg/kg
|
Greutatea corporală a câinelui |
Număr de comprimate |
|||||||
|
Libră |
Kilograme |
Doza |
10 mg |
15 mg |
50 mg |
|||
|
11.0 – 11,8 |
5,0 – 5,3 |
15 mg |
||||||
|
11.9 – 15,2 |
5,4 – 6,9 |
20 mg |
||||||
|
15.3 – 18,5 |
7,0 – 8,4 |
25 mg |
||||||
|
18.6 – 22,0 |
8,5 – 10,0 |
30 mg |
||||||
|
22.1 – 25,4 |
10,1 – 11,5 |
35 mg |
||||||
|
25.5 – 28,7 |
11,6 – 13,0 |
40 mg |
||||||
|
28.8 – 32,2 |
13,1 – 14,6 |
45 mg |
||||||
|
32.3 – 35,5 |
14,7 – 16,1 |
50 mg |
||||||
|
35.6 – 38,8 |
16,2 – 17,6 |
55 mg |
||||||
|
38.9 – 42,3 |
17,7 – 19,2 |
60 mg |
||||||
|
42,4 – 45.6 |
19,3 – 20,7 |
65 mg |
||||||
|
45,7 – 50.7 |
20,8 – 23,0 |
70 mg |
||||||
|
50,8 – 59,3 |
23.1 – 26,9 |
80 mg |
||||||
|
59,4 – 65,9 |
27.0 – 29,9 |
95 mg |
||||||
|
66,0 – 71,2 |
30,0 – 32.3 |
100 mg |
||||||
|
71,3 – 76,3 |
32,4 – 34.6 |
110 mg |
||||||
|
76,4 – 79,6 |
34,7 – 36.1 |
115 mg |
||||||
|
79,7 – 84,7 |
36,2 – 38.4 |
120 mg |
||||||
|
84,8 – 94.8 |
38,5 – 43,0 |
130 mg |
||||||
|
94.9 – 105,0 |
43,1 – 47,6 |
150 mg |
||||||
|
105.1 – 110,0 |
47,7 – 49,9 |
160 mg |
||||||
|
110.1 – 113,5 |
50,0 – 51,5 |
165 mg |
||||||
|
113.6 – 118,6 |
51,6 – 53,8 |
170 mg |
||||||
|
118.7 – 128,8 |
53,9 – 58,4 |
180 mg |
||||||
|
128.9 – 138,9 |
58,5 – 63,0 |
200 mg |
||||||
|
139.0 – 144,0 |
63,1 – 65,3 |
210 mg |
||||||
|
144.1 – 157,6 |
65,4 – 71,5 |
215 mg |
||||||
|
157.7 – 173,1 |
71,6 – 78,5 |
250 mg |
||||||
|
173.2 – 177,9 |
78,6 – 80,7 |
260 mg |
||||||
|
178.0 – 191,6 |
80,8 – 86,9 |
265 mg |
||||||
|
191.7 – 220,5 |
87,0 – 100,0 |
300 mg |
||||||
Tabelul 2: Modificarea dozei pe baza toxicității observate
|
Toxicitate |
Ajustarea dozei |
|
Neutropenie |
|
|
>1000/µL |
Menținerea nivelului dozei |
|
≤1000/µL sau febră neutropenică sau infecție |
Întrerupeți tratamentul până când >1000/µL și semnele clinice sunt normale; apoi se reduce doza cu 0.5 mg/kg |
|
Toxicități renale (creatinină) |
|
|
<2.0 mg/dL |
Menținerea nivelului dozei |
|
≥2,0 mg/dL |
Întreruperea tratamentului până când <2.0 mg/dL apoi reduceți doza cu 0,5 mg/kg |
|
Albumina |
|
|
<1,5 g/dL |
Întrerupeți medicamentul până la >2.5 g/dL, apoi reduceți doza cu 0,5 mg/kg |
|
Hematocrit |
|
|
<26% |
Întrerupeți medicamentul până la >30%, apoi reduceți doza cu 0,5 mg/kg |
|
Diarree |
|
|
<4 scaune apoase/zi timp de mai puțin de 2 zile |
Mă mențineți nivelul dozei și institui îngrijiri de susținere |
|
≥4 scaune apoase/zi sau ≥ 2 zile |
Întrerupeți medicamentul până la scaune formate și institui îngrijiri de susținere. La reluarea administrării, micșorați doza cu 0,5 mg/kg |
|
GI Sângerare |
|
|
Sânge proaspăt în scaun sau scaun negru gudronat timp de > 2 zile sau hemoragie sinceră sau cheaguri de sânge în scaun. |
Întrerupeți medicamentul și instituiți îngrijire de susținere până la dispariția tuturor semnelor clinice de sânge în scaun, apoi reduceți doza cu 0.5 mg/kg. |
Contraindicații
Nu se utilizează la câinii folosiți pentru reproducere sau la cățelele gestante sau care alăptează (vezi Farmacologie clinică).
Atenționări
PALLADIA poate provoca disfuncții vasculare care pot duce la edem și tromboembolism, inclusiv tromboembolism pulmonar. Întrerupeți administrarea medicamentului până când semnele clinice și patologia clinică s-au normalizat. Pentru a asigura homeostazia vasculară, așteptați cel puțin 3 zile după oprirea medicamentului înainte de a efectua o intervenție chirurgicală (vezi Reacții adverse).
Complicații gastrointestinale grave și uneori fatale, inclusiv perforație gastrointestinală, au apărut rar la câinii tratați cu PALLADIA (vezi Reacții adverse). Dacă se suspectează ulcerație gastrointestinală, întrerupeți administrarea medicamentului și tratați în mod corespunzător.
Atenționări la om:
NU SE UTILIZEAZĂ LA OAMENI. PĂSTRAȚI ACEST MEDICAMENT ȘI TOATE MEDICAMENTELE ÎN AFARA RAZEI DE ACȚIUNE A COPIILOR. Copiii nu trebuie să vină în contact cu PALLADIA. Țineți copiii departe de fecalele, urina sau voma câinilor tratați. Pentru a evita expunerea la medicament, spălați-vă pe mâini cu apă și săpun după administrarea PALLADIA și purtați mănuși de protecție pentru a preveni contactul direct cu fecalele, urina, voma și comprimatele PALLADIA rupte sau umezite. Așezați toate deșeurile într-o pungă de plastic și sigilați-o înainte de eliminarea generală. În cazul în care ochii sunt expuși accidental la medicament, clătiți imediat ochii cu apă. În caz de ingestie accidentală de către o persoană, solicitați imediat sfatul medicului, arătați prospectul sau eticheta medicului. În cazul în care acest medicament este ingerat accidental, pot apărea disconfort gastro-intestinal, cum ar fi vărsături sau diaree.
Femeile gravide, femeile care pot rămâne însărcinate sau mamele care alăptează trebuie să acorde o atenție deosebită acestor precauții de manipulare. (Vezi instrucțiunile de manipulare de mai sus.) PALLADIA, ca și alte medicamente din clasa sa, împiedică formarea de noi vase de sânge în tumori. În mod similar, PALLADIA poate afecta formarea vaselor de sânge la fătul în curs de dezvoltare și poate dăuna copilului nenăscut (poate provoca malformații congenitale). Pentru femeile gravide, ingestia accidentală de PALLADIA poate avea efecte adverse asupra sarcinii.
Precauții
Întrerupeți temporar utilizarea PALLADIA dacă apar simultan anemie, azotemie, hipoalbuminemie și hiperfosfatemie. Reluați tratamentul cu o reducere a dozei de 0,5 mg/kg după 1 până la 2 săptămâni când valorile s-au îmbunătățit și albumina este >2,5 g/dL. Poate fi necesară întreruperea temporară a tratamentului dacă oricare dintre acestea apare singur: hematocrit <26%, creatinină ≥2,0 mg/dL sau albumină <1,5 g/dL. Apoi, se reia tratamentul cu o reducere a dozei de 0,5 mg/kg odată ce hematocritul este >30%, creatinina este <2,0 mg/dL și albumina este >2,5 g/dL.
Întrerupeți temporar utilizarea PALLADIA dacă numărul neutrofilelor este ≤1000/µL. Reluați tratamentul după 1 până la 2 săptămâni la o reducere a dozei de 0,5 mg/kg, când numărul neutrofilelor a revenit la >1000/µL. Pot fi necesare reduceri suplimentare ale dozei dacă neutropenia severă reapare.
Prezența unei tumori mastocitare sistemice înainte de tratament poate predispune câinele la degranulare mastocitară semnificativă din punct de vedere clinic, cu posibile reacții adverse sistemice severe, atunci când este tratat cu PALLADIA. Trebuie să se încerce să se excludă mastocitoza sistemică înainte de inițierea tratamentului cu PALLADIA.
PALLADIA a fost asociat cu diaree severă sau hemoragie gastrointestinală care necesită tratament prompt. Pot fi necesare întreruperi și reduceri de doză în funcție de severitatea semnelor clinice. (A se vedea tabelul 2 din secțiunea Doze și mod de administrare.)
Utilizați cu prudență medicamentele antiinflamatoare nesteroidiene împreună cu PALLADIA datorită riscului crescut de ulcerație sau perforație gastrointestinală.
PALLADIA este metabolizat în ficat. Administrarea concomitentă a PALLADIA cu inhibitori puternici ai familiei CYP3A4 poate crește concentrațiile de PALLADIA. Nu a fost evaluat efectul medicamentelor concomitente care pot inhiba metabolismul PALLADIA. Compatibilitatea medicamentelor trebuie monitorizată la pacienții care necesită medicație concomitentă.
Nu a fost evaluată utilizarea în siguranță a PALLADIA la câinii cu vârsta mai mică de 24 de luni sau cu greutatea mai mică de 5 kg.
Reacții adverse
Un studiu clinic de teren din SUA, alcătuit dintr-o fază mascată de 6 săptămâni, urmată de o fază deschisă, a evaluat siguranța și eficacitatea PALLADIA la 151 de câini deținuți de clienți care prezentau tumori mastocite cutanate recurente de gradul II sau III, de tip Patnaik, cu sau fără afectare ganglionară regională. Cele mai frecvente reacții adverse raportate în timpul fazei mascate sunt rezumate în tabelul 3; cele raportate pe parcursul întregului studiu (faza mascată combinată cu faza deschisă) sunt rezumate în tabelul 4.
Tabelul 3. Rezumatul celor mai frecvente reacții adverse în timpul fazei mascatea
|
Placebo (n = 64) |
PALLADIA (n = 87) |
||||
|
Adverse Reacție adversă |
Cu orice gradb |
Gradul 3 sau 4b |
Cu orice gradb |
Gradul 3 sau 4b |
|
|
Diarree |
26.6% |
3.1% |
46.0% |
6,9% |
|
|
Anorexie |
31,3% |
6,3% |
6.3% |
39,1% |
6,9% |
|
Letargie |
29.7% |
3.1% |
35.6% |
4.6% |
|
|
Vomită |
32,8% |
6,3% |
32,2% |
9.2% |
|
|
Lămâie |
9,4% |
0,0% |
17.2% |
0,0% |
|
|
Pierdere în greutate |
3,1% |
0,0% |
0.0% |
14,9% |
1,1% |
|
Sânge în fecale/sângerare gastrointestinală/diaree hemoragică |
3.1% |
0.0% |
12.6% |
2.3% |
|
|
Tulburări musculo-scheletice |
6,3% |
0.0% |
11,5% |
1,1% |
|
|
Dedeshidratare |
4.7% |
0.0% |
9.2% |
2.3% |
|
|
Dermatită |
9,4% |
1,6% |
9,2% |
0.0% |
|
|
Prurit |
4,7% |
0,0% |
9.2% |
0,0% |
|
|
Tachipnee |
4.7% |
0,0% |
8,0% |
1,1% |
|
|
Dureri localizate |
4,7% |
0,0% |
8.0% |
0,0% |
|
|
Nausee |
3,1% |
0,0% |
0.0% |
8,0% |
1,1% |
|
Dureri generale |
4.7% |
1,6% |
6,9% |
0,0% |
|
|
Polidipsie |
7,8% |
0.0% |
6,9% |
0,0% |
|
|
Pirexie |
3.1% |
0.0% |
5.7% |
2.3% |
|
|
Flatulență |
3,1% |
0,0% |
5.7% |
0,0% |
|
|
Turbare de pigmentare |
1.6% |
0.0% |
5.7% |
0.0% |
|
|
Anomalie de laborator |
Cel puțin Grad |
Gradul 3 sau 4c |
Cel puțin Gradec |
Gradul 3 sau 4c |
|
|
Neutropenie |
6.3% |
0.0% |
46.0% |
0,0% |
|
|
Trombocitopenie |
20,3% |
0,0% |
24,1% |
0,1% |
0,0% .0% |
|
Creșterea alanin aminotransferazei |
21,9% |
4.7% |
24,1% |
1,1% |
|
|
Hipoalbuminemie |
7.8% |
0,0% |
12,6% |
0,0% |
|
|
Diminuarea hematocritului |
7,8% |
0.0% |
5,7% |
3,4% |
|
|
Hiperbilirubinemie |
1.6% |
1.6% |
5.7% |
0.0% |
|
|
Creșterea creatininei |
4,7% |
0,0% |
5.7% |
0,0% |
|
|
Infecție a tractului urinar |
1.6% |
0,0% |
5,7% |
0,0% |
|
a Durata medie a studiului în timpul fazei mascate a fost de 37,0 zile pentru câinii tratați cu PALLADIA (mediana, 42.0 zile) și 27,6 zile pentru câinii tratați cu placebo (mediana, 21,0 zile); nu s-au făcut ajustări în comparațiile statistice pentru această disparitate.
b Investigatorii au atribuit un grad de severitate de 1, 2, 3 sau 4 (1 – cel mai puțin sever; 4 – cel mai sever).
c Gradul de clasificare a anomaliilor de laborator s-a bazat pe ghidul Common Toxicity Criteria al Institutului Național de Cancer adaptat pentru canini (1 – cel mai puțin sever; 4 – cel mai sever).
Tabelul 4. Rezumatul celor mai frecvente reacții adverse pe parcursul studiului (faza mascată combinată cu faza deschisă-label phase)a
|
PALLADIA (n = 145) a |
|||
|
Reacții adverse |
|||
|
Reacții adverse |
Cu orice gradb |
Gradul 3 sau 4b |
|
|
Diarree |
58.6% |
8,3% |
|
|
Anorexie |
49.7% |
8,3% |
|
|
Vomită |
47.6% |
9,7% |
|
|
Letargie |
39,3% |
4.1% |
|
|
Lămurire |
22,8% |
0,0% |
|
|
Pierdere în greutate |
21,4% |
2.8% |
|
|
Sânge în scaun/sângerare gastrointestinală/ diaree hemoragică |
18.6% |
2,8% |
|
|
Deshidratare |
15,2% |
2,2% |
2.1% |
|
Prurit |
12,4% |
0,0% |
|
|
Turbare de pigmentare |
11.7% |
0,0% |
|
|
Dermatită |
11.0% |
0,0% |
|
|
Tulburări musculo-scheletice |
11,0% |
0,0% |
|
|
Dureri generale |
8.3% |
0,0% |
|
|
Otită externă |
8.3% |
0,0% |
|
|
Tachipnee |
8,3% |
0,0% |
0.0% |
|
Nausee |
7,6% |
1.4% |
|
|
Polidipsie |
7,6% |
0,0% |
|
|
Piurexie |
6.9% |
2,8% |
|
|
Artrita |
6,2% |
0,0% |
|
|
Edem localizat |
6.2% |
0,0% |
|
|
Infecție cutanată bacteriană |
5,5% |
0,0% |
|
|
Conjunctivită |
5.5% |
0.0% |
|
|
Anomalii de laborator |
Câte un Grad |
Gradul 3 sau 4c |
|
|
Neutropenie |
44.8% |
1,4% |
|
|
Hipoalbuminemie |
28,3% |
1.4% |
|
|
Trombocitopenie |
28,3% |
2.1% |
|
|
Creștere a alanin aminotransferazei |
27,6% |
4.1% |
|
|
Diminuarea hematocritului |
11,0% |
2.8% |
|
|
Creștere a creatininei |
13,8% |
1,4% |
|
|
Hiperbilirubinemie |
6,9% |
0.0% |
|
|
Infecție a tractului urinar |
7,6% |
0,0% |
|
a Durata tratamentului cu PALLADIA a variat de la 2 la 812 zile (media, 144 zile; mediana, 68 zile). Toți câinii au primit cel puțin 1 doză de PALLADIA.
b Investigatorii au atribuit un grad de severitate de 1, 2, 3 sau 4 (1 – cel mai puțin sever; 4 – cel mai sever).
c Gradarea anomaliilor de laborator s-a bazat pe ghidul Common Toxicity Criteria al Institutului Național al Cancerului adaptat pentru canini (1 – cel mai puțin sever; 4 – cel mai sever).
Au fost raportate și alte reacții adverse, dar au apărut la < 5% dintre câini. Este posibil ca orice câine individual să fi avut mai multe evenimente adverse.
Au existat 5 decese în timpul acestui studiu care au fost posibil legate de medicament. Constatările patologice au relevat, în general, dovezi de disfuncție vasculară, inclusiv tromboembolism pulmonar (postoperator); insuficiență multiorganică asociată cu vasculită și tromboză; tromboză vasculară cu coagulopatie intravasculară diseminată (CID) și pancreatită; și vasculită cu CID. Un câine a murit în urma unei perforații gastrice; durata tratamentului cu PALLADIA a fost de 221 de zile și nu a existat nicio dovadă de tumoră mastocitară la necropsie. Aceste decese au survenit în prezența sau absența unor afecțiuni grave; durata tratamentului a variat de la 18 la 221 de zile.
Nu se cunoaște relația dintre următoarele decese și medicament. Un câine, tratat inițial timp de 3 săptămâni cu un placebo, a murit din cauză necunoscută la 7 zile după inițierea tratamentului cu PALLADIA. Un alt câine a murit din cauză necunoscută la 92 de zile după inițierea tratamentului cu PALLADIA. Nu s-a efectuat necropsia la niciunul dintre cei doi câini.
Vreo 27 de câini au dezvoltat o formă de hemoragie gastrointestinală, 2,8% dintre câini având hemoragii severe. Un câine a dezvoltat ulcerație gastrică care a fost posibil legată de medicament. Trei câini au murit din cauza perforațiilor gastrice (1 câine) sau duodenale (2 câini) în timpul studiului. Un câine cu perforație duodenală a primit doar o singură doză de medicament în studiu și, prin urmare, nu a fost considerat legat de medicament.
Șapte câini au dezvoltat depigmentare nazală în primele câteva săptămâni de tratament. Unsprezece câini au dezvoltat modificări ale culorii blănii sau ale pielii în timpul studiului. Doi dintre acești câini au avut modificări complete ale culorii blănii, de la faon la alb și de la roșu intens la blond. Șapte câini au prezentat alopecie.
Există un efect legat de medicament asupra greutății corporale: 20,0% dintre câini au avut >13% pierdere în greutate în faza mascată plus faza cu etichetă deschisă atribuită medicamentului. Dintre aceștia, 5 câini au avut >25% pierdere în greutate.
Trei câini au avut activitate de tip convulsivant în timpul tratamentului cu medicamentul studiat. Nu se poate stabili dacă acestea au fost legate de medicament.
Doi câini au dezvoltat epistaxis care nu a fost asociat cu trombocitopenia. Un alt câine a dezvoltat epistaxis cu coagulopatie intravasculară diseminată concomitentă.
Pentru o copie a Fișei cu date de securitate (FDS) sau pentru a raporta evenimente adverse, sunați la Zoetis la numărul de telefon 1-888-963-8471.
Informații pentru proprietarii de câini:
Întotdeauna furnizați Fișa de informații pentru clienți împreună cu rețeta și revizuiți-o cu proprietarii. Proprietarii trebuie să fie sfătuiți cu privire la posibilele reacții adverse și la momentul în care trebuie să întrerupă medicamentul și să sune la medicul veterinar. Proprietarii trebuie să fie sfătuiți cu privire la instrucțiunile de manipulare.
Farmacologie clinică
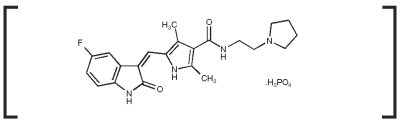
Mecanism de acțiune: Fosfatul de toceranib este o moleculă mică care are atât activitate antitumorală directă, cât și antiangiogenică. În studiile de farmacologie non-clinică, toceranibul a inhibat selectiv activitatea tirosin-kinazică a mai multor membri ai familiei de receptoare tirosin-kinazice divizate (RTK), dintre care unii sunt implicați în creșterea tumorală, angiogeneza patologică și progresia metastatică a cancerului. Toceranibul a inhibat activitatea tirozin kinazei Flk-1/KDR (receptorul factorului de creștere endotelială vasculară, VEGFR2), a receptorului factorului de creștere derivat din trombocite (PDGFR) și a receptorului factorului celulelor stem (Kit) atât în testele biochimice, cât și în cele celulare. S-a demonstrat că toceranibul exercită un efect antiproliferativ asupra celulelor endoteliale in vitro. Tratamentul cu toceranib poate induce oprirea ciclului celular și apoptoza ulterioară în liniile celulare tumorale care exprimă mutații activatoare în RTK-ul kinazei divizate, ckit. Creșterea tumorilor mastocitare canine este frecvent determinată de mutații activatoare în c-kit.1,2
Se știe că alți compuși din clasa de agenți antineoplazici antiangiogeneză cresc embrioletalitatea și anomaliile fetale. Deoarece angiogeneza este o componentă critică a dezvoltării embrionare și fetale, este de așteptat ca inhibarea angiogenezei în urma administrării de PALLADIA să aibă ca rezultat efecte adverse asupra sarcinii la cățea.
Farmacocinetică
În urma administrării intravenoase, farmacocinetica toceranibului este caracterizată de un volum de distribuție foarte mare (>20 L/kg, ceea ce indică o partiție în țesuturi), un timp de înjumătățire prin eliminare terminală de aproximativ 16 ore și un clearance de >1 L/h/kg. Cu un regim de doze de 3,25 mg echivalent de bază liberă (fbe)/kg de toceranib administrate pe cale orală sub formă de comprimate, o dată la două zile, timp de 2 săptămâni (7 doze), parametrii farmacocinetici ai toceranibului în plasmă la câinii Beagle sănătoși (între 7,2 – 12,5 kg) sunt prezentați în tabelul de mai jos.
Tabelul 5: Parametrii farmacocinetici
|
Parametri farmacocinetici (medie + 1SD) |
Total (n=11;6M, 5F) |
Total (n=10; 5M, 5F) |
|
Viața de înjumătățire de eliminare, t1/2 (h) |
16.4 ± 3,6 |
17,2 ± 3,9 |
|
Timp până la concentrația plasmatică maximă, Tmax (h) |
5.3 ± 1.6 |
6.2 ± 2.6 |
|
Concentrația plasmatică maximă, Cmax (ng/mL) |
86 ± 22 |
109 ± 41 |
|
Cmin (ng/mL) a, b |
12.7 ± 6.0 |
18.7 ± 8.3 |
|
Arie sub curba în timp a concentrației plasmatice, AUC0-48 (ng-h/mL) a |
1833 ± 508 |
2635 ± 939 |
a Valoare normalizată în funcție de doză (ajustată la 3.25 mg/kg doză)
b Cmin este concentrația la 48 h după administrarea dozei, care corespunde intervalului de dozare.
Biodisponibilitatea orală a toceranibului este de 77%. PALLADIA se leagă foarte bine de proteine în proporție de 91% până la 93%.
Trebuie remarcat faptul că, în ciuda omogenității subiecților incluși în acest studiu, s-a observat o variabilitate mare între subiecți. Indiferent de calea de administrare, a fost observată o farmacocinetică liniară la doze de până la 5 mg/kg de două ori pe zi. Utilizând un sistem de testare in vitro a hepatocitelor și a microsomelor hepatice, s-a constatat că izomerul Z a fost metabolizat în derivat N-oxid de toceranib la câini, oameni, pisici și șobolani. Deși s-a observat o mică diferență de sex în studiul in vitro (81% conversie la câinii masculi, 56% conversie la câinii femele), nu s-a observat nicio diferență în farmacocinetica toceranibului in vivo. Efectele insuficienței renale, ale insuficienței hepatice sau ale rasei asupra farmacocineticii toceranibului nu au fost investigate.
Eficacitate
Eficacitatea și siguranța PALLADIA comprimate orale pentru tratamentul tumorilor mastocitare a fost evaluată într-un studiu clinic de teren multicentric, randomizat, controlat cu placebo, dublu-mascat. Scopul acestui studiu a fost de a evalua eficacitatea și siguranța PALLADIA în tratamentul tumorilor mastocitare la câinii care prezentau o boală măsurabilă recurentă după operație și de a evalua răspunsul obiectiv (răspuns complet sau parțial). Tratamentul cu PALLADIA a fost comparat cu tratamentul cu placebo folosind ratele de răspuns la sfârșitul fazei mascate de 6 săptămâni. Ratele de răspuns au fost determinate cu ajutorul Ghidului 3 al Institutului Național al Cancerului privind criteriile de evaluare a răspunsului în tumorile solide (Response Evaluation Criteria in Solid Tumors Guideline3), care a fost modificat în mod specific pentru evaluarea tumorilor mastocitare canine.
Oricicent cincizeci și trei de câini au fost repartizați în mod aleatoriu la tratament cu 3,25 mg/kg PALLADIA (n = 88) sau placebo (n = 65) pe cale orală, o dată la două zile, timp de 6 săptămâni, sau până la progresia bolii sau retragerea din studiu din altă cauză. Tratamentul a fost demascat în momentul progresiei bolii: câinilor care au primit placebo li s-a oferit apoi trecerea la PALLADIA în regim deschis; câinii care au primit PALLADIA au fost retrași din studiu. Câinii trebuiau să aibă tumori mastocitare cutanate de gradul II sau III, recurente, de tip Patnaik, cu sau fără afectarea ganglionilor limfatici regionali. Cel puțin 1 tumoare trebuia să aibă un diametru de cel puțin 20 mm. Câinii au avut o limită de 1 protocol de radioterapie finalizat și o limită de 1 regim de chimioterapie sistemică anterioară. Au fost excluși câinii cu dovezi de tumoră mastocitară sistemică. Nu a fost permis tratamentul cu corticosteroizi sistemici în timpul studiului sau în ultimele 14 zile înainte de inițierea studiului. Dacă a fost necesar pentru a gestiona reacțiile adverse, au fost prescrise întreruperi ale dozei (încetarea tratamentului cu PALLADIA timp de până la 2 săptămâni) și/sau doza a fost redusă până la 2,2 mg/kg.
Analiza eficacității a arătat un avantaj semnificativ din punct de vedere statistic pentru PALLADIA față de placebo în ceea ce privește criteriul principal de eficacitate al răspunsului obiectiv la finalul fazei mascate de șase săptămâni. Răspunsul obiectiv reprezintă răspuns complet + răspuns parțial. Răspunsul parțial este ≥ 30% scădere a sumei celui mai lung diametru al leziunilor țintă, luând ca referință suma inițială, neprogresia leziunilor care nu sunt țintă și apariția niciunei leziuni noi.
Tumor cu celule mamare – Rezultatele parametrilor primari de eficacitate
|
Parametru de eficacitate |
Placebo (n = 63) |
PALLADIA (n = 86) |
P-.value |
|
Rata de răspuns obiectiv * |
7.9% |
37.2% |
< 0.001 |
* Diferența în ceea ce privește rata de răspuns obiectiv între grupuri nu a fost asociată în mod semnificativ cu încărcătura tumorală (prezența vs. absența afectării ganglionilor limfatici regionali) sau cu gradul tumoral (P > 0,05).
În timpul studiului, PALLADIA a fost administrat concomitent cu alte medicamente, cum ar fi antimicrobiene, blocante ale receptorilor H-2, antihistaminice, antiemetice, antiinflamatoare nesteroidiene, medicamente antiulceroase cu acțiune locală, modificatori ai motilității gastrointestinale opiacee, opioide, vaccinuri, antihelmintice, antiparazitare și preparate corticosteroide topice/oftalmice/otice. Numai în timpul fazei deschise, 5 câini au primit o scurtă cură de corticosteroizi cu acțiune scurtă.
Siguranța la animale:
În studiul de siguranță la animale țintă prezentat mai jos, s-a demonstrat că PALLADIA are o marjă de siguranță îngustă; câinii care sunt tratați cu PALLADIA trebuie monitorizați pentru reacții adverse care pot indica faptul că este necesară o ajustare a dozei. Doi câini din grupul cu 6 mg/kg au fost eutanasiați din cauza unor toxicități clinice în zilele 23 și, respectiv, 27 ale studiului.
Toceranib a fost administrat pe cale orală la 20 de câini Beagle adulți masculi și 20 de femele (cu vârsta de aproximativ 2 ani) în doze de 0 mg/kg (placebo, 12 câini), 2 mg/kg (0,5X, 8 câini), 4 mg/kg (1X, 12 câini) sau 6 mg/kg (1,5X, 8 câini) o dată la două zile, timp de 13 săptămâni consecutive, fără întreruperea dozei. Toceranibul a provocat pierdere în greutate, scăderea consumului de hrană, modificări pancreatice, gonadale, suprarenale, musculare și hematopoietice.
Consumul de hrană a scăzut în grupul cu 6 mg/kg în comparație cu placebo, cu cea mai mare diferență de medii care a avut loc la ziua 35. Scăderi ale greutății corporale în grupul cu 4 mg/kg au fost observate la Ziua 31 și în grupul cu 6 mg/kg la Ziua 15 comparativ cu placebo și au continuat pe parcursul studiului. Șchiopătarea legată de doză, observată aproape exclusiv la nivelul membrelor posterioare, și durerea la nivelul membrelor a fost mai mare în toate grupurile de tratament în comparație cu placebo, grupul de 6 mg/kg prezentând cea mai mare incidență. Rigiditatea și slăbiciunea au fost observate ca apărând aproape exclusiv în grupul cu 6 mg/kg. Înroșirea mucoasei bucale a fost observată la toate grupurile de tratament. Un câine din grupul cu 4 mg/kg a prezentat ulcerații orale și un câine din grupul cu 6 mg/kg a prezentat ulcerații cutanate, ambele cu infecții bacteriene prezente. Diareea sau scaunul moale au fost observate la toate cele patru grupuri.
Analizele hematologice au arătat scăderi ale hematocritului, hemoglobinei și numărului de eritrocite și o scădere a numărului de reticulocite la grupurile cu 4 și 6 mg/kg care au avut tendința de a se recupera suficient pentru a limita scăderea în continuare a numărului de eritrocite. Numărul de globule albe a fost semnificativ mai mic pe toată durata studiului în toate grupurile tratate comparativ cu placebo, în principal din cauza scăderii numărului de neutrofile. Limfocitele au scăzut într-o măsură mai mică, în special la doza mică. Eozinofilele și bazofilele au prezentat scăderi marcate și persistente. Monocitele nu au fost afectate.
Conturile de trombocite au crescut ușor în grupurile cu 4 și 6 mg/kg. Au fost observate creșteri ale fibrinogenului în grupul cu 4 și 6 mg/kg.
Au fost observate creșteri ale concentrațiilor de aspartat aminotransferază, creatin-kinază și fosfor seric în grupurile cu 4 și 6 mg/kg. S-au observat creșteri ale fosfatazei alcaline în grupul cu 6 mg/kg. O creștere a amilazei a fost observată la un câine din fiecare dintre grupurile de tratament. S-a observat o creștere a potasiului seric la un câine din grupul cu 6 mg/kg. S-au observat creșteri ale lactat dehidrogenazei și globulinelor în grupul cu 6 mg/kg.
Schimbările microscopice legate de tratament au inclus o reducere ușoară până la marcată a celularității măduvei osoase sternale și femurale. A existat o ușoară hematopoieză extramedulară corespunzătoare, în principal eritropoieză, în splină. În pancreas, a avut loc o degranulare acinară ușoară până la moderată legată de doză, caracterizată prin pierderea difuză a granulelor de zimogen. În glandele suprarenale, a apărut congestie corticală/hemoragie minimă la toate dozele, cu o relație sugestivă cu doza. Vacuolarea corticală suprarenală a fost observată cu frecvență redusă la toate grupurile. Modificări legate de doză au fost observate în organele de reproducere ale ambelor sexe. Masculii au prezentat o epuizare a celulelor germinale legată de doză, vacuolare tubulară și reduceri ale numărului de spermatozoizi maturi. La femele, ovarele au prezentat o incidență redusă a corpora lutea maturi/în regresie și o incidență crescută a foliculilor mici.
Doi câini (un mascul, o femelă) din grupul cu 6 mg/kg au fost eutanasiați din cauza toxicităților clinice legate de tratament în zilele 23 și, respectiv, 27 ale studiului. Debutul sindromului terminal s-a manifestat prin reducerea marcată a consumului de hrană și melenă. În următoarele 9 zile, scăderea aportului de hrană a progresat până la anorexie aproape completă și a apărut hematochezia. Au fost observate scădere în greutate, letargie, șchiopătare și slăbiciune a membrelor posterioare. Următoarele rezultate de patologie clinică sunt în concordanță cu modificările observate la ceilalți câini din grupul cu 6 mg/kg, precum și cu modificările datorate stării de slăbiciune a câinilor chiar înainte de eutanasiere. Ambii câini au prezentat creșteri ale proteinelor totale, globulinelor, fosforului, colesterolului, trigliceridelor și fibrinogenului. Un câine a prezentat pancitopenie, scăderea hematocritului, hemoglobinei, reticulocitelor, albuminei și PT și creșterea benzilor. Era prezentă și hematuria. Celălalt câine prezenta, de asemenea, o scădere a limfocitelor, a eozinofilelor, a clorului și a sodiului și creșteri ale hematiilor, hematocritului, hemoglobinei, trombocitelor, ALP, amilazei, creatininei, BUN, magneziului, potasiului și bilirubinei totale. Profilul de coagulare a arătat o scădere a PT și o creștere a PTT la ambii câini. Acești câini au prezentat o depleție limfoidă la nivelul ganglionilor limfatici, al timusului și al țesuturilor limfatice asociate intestinului și leziuni gastrointestinale ușoare până la marcate, în plus față de constatările microscopice descrise la animalele care au supraviețuit până la sfârșitul studiului. Acești doi câini prezentau, de asemenea, leziuni la nivelul tractului gastrointestinal, rinichilor, pancreasului, glandei pituitare și glandelor suprarenale.
Condiții de depozitare: A se păstra la o temperatură controlată a camerei de 20° până la 25° C (68° până la 77° F).
Cum se administrează
Comprimatele PALLADIA conțin 10 mg, 15 mg sau 50 mg de toceranib sub formă de fosfat de toceranib pe comprimat. Comprimatele sunt ambalate în flacoane a câte 30 de comprimate.
1 London CA, Hannah AL, Zadovoskaya R, et al. Phase I Dose-Escalating Study of SU11654, a Small Molecule Receptor Tyrosine Kinase Inhibitor, in Dogs with Spontaneous Malignancies. Clinical Cancer Research 9(7):2755-2768; 2003
2 Pryer NK, Lee LB, Zadovoskaya R, et al. Proof of Target for SU11654: Inhibition of KIT phosphorylation in Canine Mast Cell Tumors. Clinical Cancer Research 9(15):5729-5734; 2003
3 http://ctep.cancer.gov/protcolDevelopment/
NADA #141-295, Aprobat de FDA
Fabricat de: Pfizer Inc, Ascoli, Italia
Distribuit de: Zoetis Inc., Kalamazoo, MI 49007
Revizuit: August 2015
.