Die Form eines Moleküls hängt von der Anzahl der Elektronenpaare in der äußersten Schale ab, die ein Zentralatom umgeben. Wenn man einmal herausgefunden hat, wie viele Bindungspaare und Nicht-Bindungspaare es gibt, ist der Rest einfach
Kurzer Hinweis zu den Bindungspaaren!
Doppelbindungen ignorieren, sie zählen als ein Bindungspaar!

z.B.. CO2 hat zu diesem Zweck nur zwei Bindungspaare (obwohl wir wissen, dass es in Wirklichkeit 4 hat, 2 Paare zwischen jedem Sauerstoff und dem Wasserstoff)
Die Formen, die Moleküle bilden, haben alle mit der Theorie der Elektronenpaarabstoßung in der Valenzschale (VSEPR) zu tun. Das hört sich kompliziert an, aber die allgemeine Regel ist, dass sich alle Paare gegenseitig abstoßen, so dass sich alle Elektronenpaare in allen drei Dimensionen ausbreiten, um sich so weit wie möglich zu entfernen. Die Formen, die durch diese Ausbreitung entstehen, sind sehr wichtig und können die Chemie des Moleküls stark beeinflussen.
| Keine Paare von e- |
Keine Paare von bindenden e- | Keine nicht Bindungspaare von e- | Name der Form | Anordnung im Raum | Bindungswinkel | Beispiele |
|---|---|---|---|---|---|---|
| 2 | 2 | 0 | Linear | 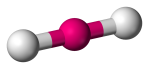 |
180o | CO2 |
| 3 | 3 | 0 | Trigonal Planar | 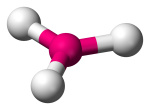 |
120o | BF3 |
| 3 | 2 | 1 | Angular, V-förmig oder gebogen |  |
120o | SO2 |
| 4 | 4 | 0 | Tetraeder | 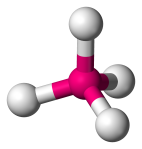 |
109.5o | CH4 |
| 4 | 3 | 1 | Trigonal Pyramidal | 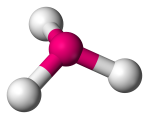 |
107o | NH3 |
| 4 | 2 | 2 | Angular, V-förmig oder gebogen |  |
104.5o | H2O |
| 6 | 6 | 0 | Oktaedrisch | 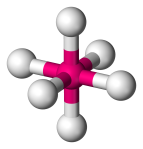 |
90o | SF6 |