Definiție: Bateria care utilizează plumb spongios și peroxid de plumb pentru transformarea energiei chimice în energie electrică, un astfel de tip de baterie se numește baterie plumb-acid. Bateria plumb-acid este cel mai frecvent utilizată în stațiile și substațiile electrice, deoarece are o tensiune mai mare a celulei și un cost mai mic.
Construcția bateriei plumb-acid
Diferitele părți ale bateriei plumb-acid sunt prezentate mai jos. Recipientul și plăcile reprezintă partea principală a bateriei plumb-acid. Recipientul stochează energia chimică care este transformată în energie electrică cu ajutorul plăcilor.
1. Recipientul – Recipientul bateriei plumb-acid este confecționat din sticlă, lemn căptușit cu plumb, ebonită, cauciucul dur al compusului bituminos, materiale ceramice sau materiale plastice turnate și sunt așezate în partea superioară pentru a evita descărcarea electrolitului. În partea de jos a recipientului se află patru nervuri, pe două dintre ele se sprijină placa pozitivă, iar celelalte susțin plăcile negative.
Prisma servește ca suport pentru plăci și, în același timp, le protejează împotriva unui scurtcircuit.Materialul din care sunt confecționate recipientele bateriilor trebuie să fie rezistent la acidul sulfuric, să nu se deformeze, să nu fie poros și să nu conțină impurități care să deterioreze electrolitul.
2. Placa – Placa celulei plumb-acid este de concepție diversă și toate constau într-o formă sau alta de grilă care este alcătuită din plumb și din materialul activ. Grila este esențială pentru conducerea curentului electric și pentru distribuirea egală a curentului pe materialul activ. Dacă curentul nu este distribuit uniform, atunci materialul activ se va desprinde și va cădea.
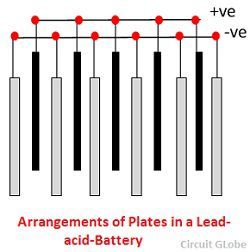 Grilele sunt alcătuite dintr-un aliaj de plumb și antimoniu. Acestea sunt realizate de obicei cu nervura transversală care traversează locurile în unghi drept sau în diagonală. Grilele pentru plăcile pozitive și negative au același design, dar grilele pentru plăcile negative sunt făcute mai ușoare, deoarece nu sunt atât de esențiale pentru conducerea uniformă a curentului.
Grilele sunt alcătuite dintr-un aliaj de plumb și antimoniu. Acestea sunt realizate de obicei cu nervura transversală care traversează locurile în unghi drept sau în diagonală. Grilele pentru plăcile pozitive și negative au același design, dar grilele pentru plăcile negative sunt făcute mai ușoare, deoarece nu sunt atât de esențiale pentru conducerea uniformă a curentului.
Placile bateriei sunt de două tipuri. Acestea sunt plăcile formate sau plăcile plante și plăcile lipite sau plăcile faure.
Plăcile plante sunt folosite în mare parte pentru bateriile staționare, deoarece acestea sunt mai grele în greutate și mai costisitoare decât plăcile lipite. Dar plăcile sunt mai durabile și mai puțin susceptibile de a pierde material activ prin încărcare și descărcare rapidă. Plăcile plantes au un raport capacitate-greutate scăzut.
Procesul Faure este mult mai potrivit pentru fabricarea plăcilor negative decât a celor pozitive. Materialul activ negativ este destul de dur și suferă o modificare relativ redusă în urma încărcării și descărcării.
3. Material activ – Materialul dintr-o celulă care participă activ la o reacție chimică (absorbție sau evoluție a energiei electrice) în timpul încărcării sau descărcării se numește materialul activ al celulei. Elementele active ale acidului de plumb sunt
- Peroxidul de plumb (PbO2) – Formează materialul activ pozitiv. PbO2 sunt de culoarea ciocolatei de mătură închisă.
- Plumbul spongios – Formează materialul activ negativ. Este de culoare gri.
- Acid sulfuric diluat (H2SO4) – Se utilizează ca electrolit. Conține 31% de acid sulfuric.
Peroxidul de plumb și plumbul spongios, care formează materialele active negative și pozitive, au rezistența mecanică mică și, prin urmare, pot fi folosite singure.
4. Separatori – Separatorii sunt foi subțiri de material neconductor alcătuite din lemn de plumb tratat chimic, cauciucuri poroase sau covoare de fibră de sticlă și sunt plasate între pozitiv și negativ pentru a le izola unul de celălalt. Separatoarele sunt canelate pe verticală pe o parte și sunt netede pe cealaltă parte.
5. Terminalele bateriei – O baterie are două terminale, cel pozitiv și cel negativ. Terminalul pozitiv, cu un diametru de 17,5 mm în partea de sus, este puțin mai mare decât terminalul negativ care are un diametru de 16 mm.
Principiul de funcționare al bateriei plumb-acid
Când acidul sulfuric se dizolvă, moleculele sale se despart în ioni pozitivi de hidrogen (2H+) și ioni negativi de sulfat (SO4-) și se mișcă liber. Dacă cei doi electrozi sunt scufundați în soluții și conectați la o sursă de curent continuu, atunci ionii de hidrogen, fiind încărcați pozitiv, se deplasează spre electrozi și sunt conectați la borna negativă a sursei de alimentare. Ionii de SO4-, fiind încărcați negativ, se deplasează spre electrozii conectați la borna pozitivă a sursei principale de alimentare (de ex, anod).
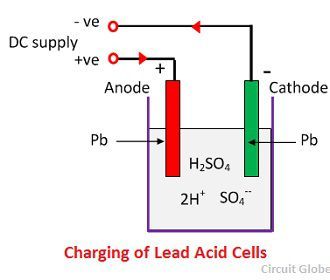 Care ion de hidrogen preia câte un electron de la catod, iar fiecare ion de sulfat preia cei doi ioni negativi de la anozi și reacționează cu apa și formează acid sulfuric și acid hidrogenic.
Care ion de hidrogen preia câte un electron de la catod, iar fiecare ion de sulfat preia cei doi ioni negativi de la anozi și reacționează cu apa și formează acid sulfuric și acid hidrogenic.
Oxigenul produs de ecuația de mai sus reacționează cu oxidul de plumb și formează peroxidul de plumb (PbO2.) Astfel, în timpul încărcării, catodul de plumb rămâne ca plumb, dar anodul de plumb se transformă în peroxid de plumb, de culoare ciocolatiu.
Dacă sursa de alimentare de curent continuu este deconectată și dacă voltmetrul se conectează între electrozi, acesta va arăta diferența de potențial dintre ei. Dacă un fir conectează electrozii, atunci curentul va trece de la placa pozitivă la placa negativă prin circuitul extern, adică celula este capabilă să furnizeze energie electrică.
Acțiune chimică în timpul descărcării
Când celula este complet descărcată, atunci anodul este din peroxid de plumb (PbO2) și un catod este din plumb spongios metalic (Pb). Când electrozii sunt conectați printr-o rezistență, celula se descarcă și electronii circulă în sens opus celui din timpul încărcării.
Ionii de hidrogen se deplasează spre anod și ajungând la anod primesc un electron de la anod și devin atom de hidrogen. Atomul de hidrogen vine în contact cu un PbO2, deci atacă și formează sulfat de plumb (PbSO4), de culoare albicioasă și apă conform ecuației chimice.
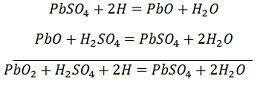
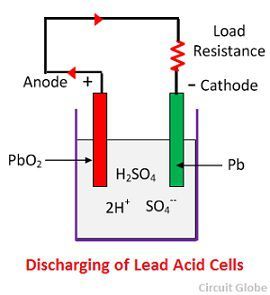 Care ion de sulfat (SO4-) se deplasează spre catod și ajungând acolo cedează doi electroni devine radical SO4, atacă catodul de plumb metalic și formează sulfat de plumb de culoare albicioasă conform ecuației chimice.
Care ion de sulfat (SO4-) se deplasează spre catod și ajungând acolo cedează doi electroni devine radical SO4, atacă catodul de plumb metalic și formează sulfat de plumb de culoare albicioasă conform ecuației chimice.
Acțiune chimică în timpul reîncărcării
Pentru reîncărcare, anodul și catodul sunt conectate la borna pozitivă și cea negativă a rețelei de alimentare de curent continuu. Moleculele de acid sulfuric se descompun în ioni de 2H+ și SO4-. Ionii de hidrogen, fiind încărcați pozitiv, se deplasează spre catozi, de unde primesc doi electroni și formează un atom de hidrogen. Atomul de hidrogen reacționează cu catodul de sulfat de plumb formând plumb și acid sulfuric conform ecuației chimice.
![]()
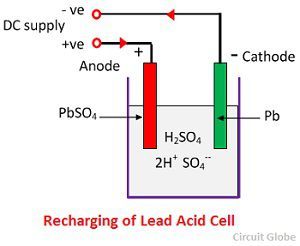 Ionul SO4- se deplasează spre anod, cedează cei doi electroni suplimentari devine radical SO4, reacționează cu anodul de sulfat de plumb și formează peroxid de plumb și acid sulfuric de plumb conform ecuației chimice.
Ionul SO4- se deplasează spre anod, cedează cei doi electroni suplimentari devine radical SO4, reacționează cu anodul de sulfat de plumb și formează peroxid de plumb și acid sulfuric de plumb conform ecuației chimice.![]() Încărcarea și descărcarea sunt reprezentate printr-o singură ecuație reversibilă dată mai jos.
Încărcarea și descărcarea sunt reprezentate printr-o singură ecuație reversibilă dată mai jos.
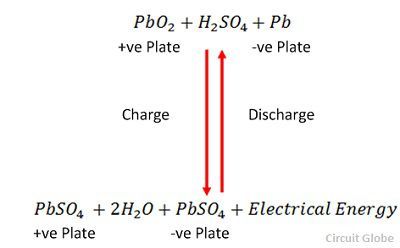 Ecuația ar trebui să se citească descrescător pentru descărcare și crescător pentru reîncărcare.
Ecuația ar trebui să se citească descrescător pentru descărcare și crescător pentru reîncărcare.