A molekula alakja a központi atomot körülvevő legkülső héjban lévő elektronpárok számától függ. Ha egyszer kiderítetted, hogy hány kötéspár és nem kötéspár van, a többi már könnyű
Gyors megjegyzés a kötéspárokról!
A kettős kötések figyelmen kívül hagyása, azok egy kötéspárnak számítanak!

pl. A CO2-nak erre a célra csak két kötéspárja van (bár tudjuk, hogy a valóságban 4 van, 2 pár minden oxigén és a hidrogén között)
A molekulák alakjának kialakulásához a Valenciahéj elektronpár-taszítás elméletének (VSEPR) van köze. Ami bonyolultnak hangzik, de az általános szabály az, hogy az összes pár taszítja egymást, így az összes elektronpár szétterül mindhárom dimenzióban, hogy minél távolabb kerüljön. Az alakzatok, amelyek ennek a szétterjedésnek a hatására alakulnak ki, nagyon fontosak, és nagymértékben befolyásolhatják a molekula kémiáját.
| Nincs pár az e- |
Nincsenek kötéspárok e- | Nincs nem- kötéspárok e- | Az alak neve | Térbeli elrendezés | kötésszögek | Példák |
|---|---|---|---|---|---|---|
| 2 | 2 | 0 | Lineáris | 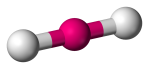 |
180o | CO2 |
| 3 | 3 | 0 | Trigonális Planar | 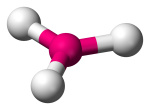 |
120o | BF3 |
| 3 | 2 | 1 | Anguláris, V alakú vagy hajlított |  |
120o | SO2 |
| 4 | 4 | 0 | Tetraéderes | 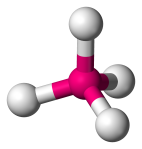 |
109.5o | CH4 |
| 4 | 3 | 1 | Trigonális piramis | 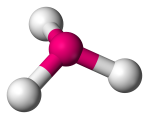 |
107o | NH3 |
| 4 | 2 | 2 | Anguláris, V alakú vagy hajlított |  |
104.5o | H2O |
| 6 | 6 | 0 | Octaéderes | 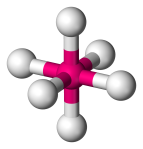 |
90o | SF6 |