Molekyylin muoto riippuu keskeistä atomia ympäröivän uloimman kuoren elektroniparien lukumäärästä. Kun saat selville, kuinka monta sidosparia ja ei-sidosparia on, loppu on helppoa
Pikahuomautus sidospareista!
Älkää huomioiko kaksoissidoksia, ne lasketaan yhdeksi sidospariksi!

jne. CO2:lla on tässä tarkoituksessa vain kaksi sidosparia (vaikka tiedämme, että todellisuudessa sillä on 4, 2 paria kunkin hapen ja vedyn välillä)
Molekyylien muodostamat muodot liittyvät kaikki Valenssikuoren elektroniparien hylkimisteoriaan (VSEPR). Mikä kuulostaa monimutkaiselta, mutta yleissääntö on, että kaikki parit hylkivät toisiaan niin, että kaikki elektroniparit levittäytyvät kaikkiin kolmeen ulottuvuuteen niin, että pääsevät mahdollisimman kauas. Muodot, jotka muodostuvat tästä leviämisestä, ovat hyvin tärkeitä ja voivat vaikuttaa molekyylin kemiaan valtavasti.
| Ei pareja e- |
Ei sidospareja e- | Ei non- sidospareja e- | muodon nimi | järjestys avaruudessa | sidoskulmat | Esimerkkejä | ||
|---|---|---|---|---|---|---|---|---|
| 2 | 2 | 2 | 0 | Lineaarinen | 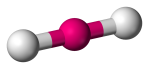 |
180o | CO2 | |
| 3 | 3 | 0 | Trigonaalinen Planar | 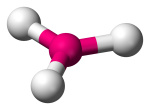 |
120o | BF3 | ||
| 3 | 2 | 1 | Angular, V-muotoinen tai taivutettu |  |
120o | SO2 | ||
| 4 | 4 | 4 | 0 | Tetraedrinen | 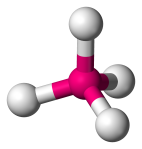 |
109.5o | CH4 | |
| 4 | 3 | 1 | Trigonaalipyramidi | 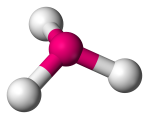 |
107o | NH3 | ||
| 4 | 2 | 2 | Angular, V-muotoinen tai taivutettu |  |
104.5o | H2O | ||
| 6 | 6 | 6 | 0 | oktaedrinen | 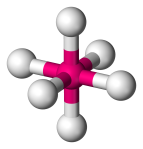 |
90o | SF6 |